Синдром поликистозных яичников.
Литобзор
Малярская М.М.
Синдром поликистозных яичников является одной из наиболее частых причин нарушения репродуктивной функции эндокринного генеза у женщин молодого возраста.
Частота синдрома поликистозных яичников (СПКЯ) в гинекологической клинике достигает 11% и у 94% больных сопровождается бесплодием. Кроме того, пациенток с СПКЯ относят к группе повышенного риска в плане возникновения гиперпластических процессов и предраковых состояний эндометрия.
В пятнадцатом издании "Merk Manual of diagnosis and therapy" дано следующее определение: "ПКЯ - гетерогенная группа нарушений с широкой клинической и биохимической вариабельностью, при которой хроническая ановуляция является следствием нарушения механизма обратной связи в гипоталамо-гипофизарной системе".
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ СИНДРОМА ПОЛИКИСТОЗНЫХ ЯИЧНИКОВ
Существуют теории гипоталамического, гипофизарного, надпочечникового, ферментативного генеза СПКЯ, каждая из которых, по-видимому, имеет право на существование ввиду многообразия факторов, приводящих к развитию патологического процесса и их различного патологического воздействия на женский организм. [23, 48, 132, 133, 137, 113]
В 60-х гг текущего столетия, когда эндокринологическая наука обогатилась новыми методами исследования, была сформулирована теория ферментативного дефекта, в основе которой лежит первичный, генетически обусловленный энзимный дефект в яичниках.
Блок энзимных систем яичника может встречаться на одном из заключительных этапов стероидогенеза - на уровне 19-гидроксилазы, в результате чего нарушается процесс ароматизации, и блокируется превращение андрогенных предшественников в эстрогены. В организме происходит чрезмерное накопление тестостерона (Т); в меньших количествах обнаруживается андростендиол, а продукция эстрогенов резко снижена и находится в прямой зависимости от степени дефицита 19-гидроксилазы.
Помимо этого, энзимный дефект может проявиться на уровне 3b-ол-дегидрогеназы. В этом случае процесс биосинтеза стероидов идет по пути накопления дегидроэпиандростерона (ДЭА). Эстрогенная насыщенность при этом варианте энзимных нарушений выше, и при отсутствии недостаточности 19-гидроксилазы может достичь почти нормального уровня.
Однако более поздние исследования овариального стероидогенеза обнаружили несостоятельность представлений об исходной ферментативной недостаточности как причине овариальной гиперандрогении при СПКЯ.
Дискутабельным остается вопрос об участии надпочечников в генезе СПКЯ. [47, 49, 95, 105] По мнению одних исследователей, повышенный синтез надпочечниками андрогенов в период менархе является инициирующим фактором в нарушении гипоталамо-гипофизарно-яичниковой регуляции менструального цикла, приводящим к ановуляции и формированию ПКЯ. [76, 86]
Н.Т. Старкова [69] выделяет клиническую форму синдрома ПКЯ, при которой первичным звеном патогенетической цепи является надпочечниковая гиперандрогения. Избыток надпочечниковых андрогенов блокирует циклическую выработку гонадотропинов гипофизом, одновременно способствует утолщению белочной оболочки яичников, нарушая овуляцию и вызывая мелкокистозную дегенерацию фолликулов. Патологические измененные яичники, в свою очередь, начинают продуцировать избыточное количество андрогенов.
В то же время Т.П. Яремчук [84] исключает первичный ферментный дефект в надпочечниках при СПКЯ.
Сравнив у больных содержание стероидов в крови, оттекающей от яичников и надпочечников, A. Milewitz и соавт. [131] пришли к выводу, что источником гиперандрогении в 1/3 случаев являются яичники, в 1/3 - надпочечники, а в остальных случаях гиперандрогения носит смешанный характер.
В настоящее время яичниковая и надпочечниковая теории генеза ПКЯ утратили свое первоначальное значение и имеют все меньше сторонников, т.к. в результате многочисленных исследований накоплено достаточное количество фактов, свидетельствующих против данных концепций патогенеза.
В частности, возможность стимуляции овуляции при воздействии ФСГ, клостильбегита, клиновидной резекции яичников, восстановление овуляции с помощью пульсирующего ведения микродоз ГТ-РГ и, наконец, возможность спонтанной овуляции и наступления беременности у больных с ПКЯ ставят под сомнение наличие значительного стероидогенетического дефекта в яичниках. Кроме того, экспериментально было показано, что при добавлении ФСГ к инкубационной среде, состоящей из гранулезных клеток, резко возрастает продукция эстрогенов как в нормальных, так и в поликистозных яичниках. [137, 144, 148, 150]
Среди этиологических факторов, связанных с возникновением и развитием СПКЯ, наследственные факторы занимают значительное место. Первое указание на связь наследственных факторов и возникновения ПКЯ было сделано в 1968г в работе Cooper и соавт. [104] в Университете Минессоты. По их данным, у родственников пробандов чаще, чем в контрольной группе, наблюдаются олигоменорея и гирсутизм. В 80-90-е гг Givens, Cohen и Simpson, а в нашей стране - Кириллова Е.А. [33, 101, 122, 153] продолжили изучение роли наследственных факторов в возникновении ПКЯ. Исследования Givens и соавт., проведенные в Мемфисе [122], показали, что ПКЯ наследуются, однако, было также в равной степени ясно, что популяция этих больных крайне гетерогенна, включая случаи с и без инсулиновой резистентности и повышенных липидов в сыворотке крови, так же как и случаи с наличием или отсутствием эпилептических припадков по типу grand mal. Наследование по единственному доминантному гену представляется маловероятным. Большинство клиницистов предполагает, что не более, чем 5-10% родственников I степени родства имеют клинические симптомы заболевания, что более характерно для полигенного наследования.
Характерная для СПКЯ повышенная атрезия фолликулов может быть связана с дефектной функцией клеток гранулезы. В связи с этим является интересным тот факт, что причиной повышенной атрезии у плодов с хромосомным набором 45,ХО была недостаточность гранулезных клеток, необходимых для выживания яйцеклеток. [95, 151, 152]
Явное вовлечение гетерохроматической Х-хромосомы в контроль атрезии, что подтверждается повышенным уровнем атрезии при дисгенезии гонад, повышает возможность того, что похожий, но менее серьезный дефект существует в некоторых случаях СПКЯ, приводящий к к увеличению атрезии фолликулов с гиперплазией тека-ткани. Повышенное число дегенеративных яйцеклеток присутствует и в некоторых яичниках с гипертекозом. При использовании культуры ткани in vitro высокое количество дегенеративных яйцеклеток в ПКЯ также было обнаружено.
Об участии генетических и средовых факторов в формировании ПКЯ свидетельствует наличие семейных форм заболевания, отягощенность родословных различными эндокринопатиями, нарушениями репродуктивной функции, сахарным диабетом, доброкачественными и злокачественными новообразованиями, а также наличие у больных повышенного инфекционного индекса, физических и психических перегрузок, частых стрессовых ситуаций пубертатного и постпубертатного возраста. Геном организма в целом и средовые факторы способны влиять на экспрессию патологических генов, что в еще большей степени отражается на клиническом полиморфизме и разнообразии течения заболевания.
Дерматоглифические данные также предполагают возможность передачи ПКЯ с Х-хромосомой. [35]
В настоящее время патогенез ПКЯ остается не до конца ясным, несмотря на большое количество исследований в этой области. Ведущей является центральная теория патогенеза ПКЯ, согласно которой данное патологическое состояние объясняется нарушениями образования нейротрансмиттеров в гипоталамической области, изменением цирхорального ритма выделения ГТ-РГ и, как следствие, количественными изменениями секреции гонадотропных гормонов: ЛГ и ФСГ. [3, 28, 134, 143, 149]
Причины возникновения такого состояния остаются невыясненными; возможно, это связано с генетически детерминированным нарушением ритма и количества выделения ГТ-РГ.
Некоторые исследователи полагают, что ведущим этиологическим фактором является стресс, приводящий к дефициту дофамина в гипоталамусе, который, как считают, способен понижать количество образующегося там же ГТ-РГ. При недостатке дофамина увеличивается амплитуда и частота цирхорального ритма выделения, вследствие чего возрастает синтез ЛГ и снижается секреция ФСГ. [94, 97, 132]
Было доказано, что при ПКЯ повышена чувствительность гипофиза к ГТ-РГ: небольшие дозы последнего стимулируют в 4 раза больше выделение ЛГ, чем в норме. Чувствительность же ФСГ к РГ, напротив, значительно ниже, кроме того, относительная гиперэстрогения, имеющая место при ПКЯ, подавляет ФСГ и стимулирует выброс ЛГ. Следует также отметить повышенное образование ингибина в гранулезе фолликулов, который тормозит выработку ФСГ. Избыток ЛГ приводит к значительному увеличению синтеза андрогенов из холестерина и ацетата в клетках внутренней теки фолликулов, где располагаются рецепторы преимущественно к ЛГ. Ароматизация андрогенов в эстрогены снижена вследствие уменьшения активности ФСГ-зависимой ароматазы в гранулезных клетках фолликулов. Недостаток ФСГ и избыток андрогенов приводят к кистозной атрезии фолликулов и формированию мелких кист, уменьшению количества слоев клеток гранулезы. Повышенная стимуляция ЛГ теки фолликулов приводит к ее гиперплазии. [95, 96, 100, 114]
С точки зрения процесса, происходящего в яичнике, суть ПКЯ - это невозможность развивающегося фолликула среди множества других фолликулов пройти селекцию. Исторически предлагались две крупные теории для объяснения отсутствия селекции фолликула при ПКЯ.
Первая теория доказывала, что селекция не происходит из-за высоких циркулирующих уровней ЛГ, вызывающих негативный ответ роста, который приводит к атрезии всех фолликулов. Краеугольным камнем всей теории является поражение ЛГ-сигнализирующего механизма в тека-интерстициальных клетках. [15, 40]
Согласно другой теории, концентрация ФСГ у пациенток с ПКЯ слишком низка, что мешает процессу выбора фолликулов. Основой этой теории является концепция, что концентрация биологически активного ФСГ в микросреде слишком низка для стимуляции роста и развития гранулезных клеток. [99, 140]
Как возможный причинный агент при ПКЯ, ФСГ на протяжении долгого времени вызывает интерес. Исследования, поддерживающие эту теорию, были проведены с помощью использования ФСГ-препарата у пациенток с ПКЯ, что позволило получить доминантные фолликулы и на основании этого предположить, что ФСГ способствовал трансдукции сигнала в гранулезных клетках, что привело к синтезу эстрадиола и овуляции. Основываясь на эти результаты, возникновение аберрантного фолликулогенеза при ПКЯ связывали с недостатком активности ФСГ в микросреде. [99, 124]
Анализируя эти данные, можно предположить, что эндогенный уровень биологически активного ФСГ в фолликулярной жидкости при ПКЯ может быть достаточно низким для того, чтобы поражать функцию фолликула. В литературе имеются сведения, что ПКЯ могут содержать в фолликулах столько же биологически активного ФСГ, сколько и в нормальном фолликуле, в связи с чем логично предположить, что, видимо, присутствует блок в передаче сигнала ФСГ.
В настоящее время предлагается третья концепция, заключающаяся в том, что факторы роста могли бы быть вовлечены в прекращение селекции фолликулов при ПКЯ. Предполагается, что аберрантные факторы роста (ИПФР-1, ИПФР-2, ЭФР, интерлейкин-1 и др.) вызывают остановку развития доминантных фолликулов при ПКЯ, оказывая влияние на рецепцию гранулезных клеток. [116, 121]
Поэтому, возможно, наиболее интересной теорией является та, которая полагает, что секрет патогенеза ПКЯ находится там, где находится локальный ингибитор гормоно-зависимой гранулезной дифференцировки.
Нарушение равновесия между андрогенами, эстрогенами и секрецией гонадотропинов является ведущим звеном в возникновении СПКЯ. Однако, до сих пор дискутируется вопрос, что первично при СПКЯ: нарушение гипоталамической регуляции или нарушение механизмов обратной связи из-за неправильной секреции стероидов яичников вследствие наличия в них ферментных дефектов.
Полагают, что секреция стероидных гормонов в процессе менструального цикла в основном объясняется различной экспрессией ферментов, ответственных за их биосинтез. [126] Это было показано при проведении анализа для определения экспрессии стероидогенетических ферментов в менструальном цикле с использованием этих ферментов в качестве проб, основанных на характерных свойствах ДНК комплементарно репродуцироваться в матричную РНК. [151]
Для того, чтобы понять механизмы экспрессии стероидогенетических ферментов, клетки человеческой гранулезы и тека-клетки были обработаны в культуре для определения эффектов различных потенциальных регуляторных факторов на экспрессию различных стероидогенетических ферментов. [129]
Используя человеческие тека-клетки в культуре, было обнаружено, что 17-a-гидроксилазная активность в этих клетках стимулировалась человеческим хорионическим гонадотропином (ХГ). Более того, такая стимуляция блокировалась присутствием различных факторов роста в культурной среде, особенно трансформирующим фактором роста b, а также фактором роста фибробластов, эпидермальным фактором роста. Напротив, ИПРФ-1 стимулировал активность 17-a-гидроксилазы в этих клетках. В тех ситуациях, когда в качестве субстрата использовался прегненолон, начальным продуктом являлся 17-a-гидроксипрегненолон, который в последующем конвертировался в ДЭА. [129]
Однако, когда в качестве субстрата использовался прогестерон, начальным продуктом был 17-a-гидроксипрогестерон, а андростендион образовывался лишь в небольших дозах. Эти результаты согласуются с известными количественными характеристиками человеческого и коровьего Р-450-17a в тех экспериментах, когда их ДНК инкубировались с опухолевыми клетками обезьяньих почек. В этих экспериментах было показано, что 17,20-лиазная активность этих ферментов оставалась интактной по отношению к дельта-4-3-кетостероидам и активна только по отношению к дельта-5-3-b-гидроксистероиду. [156]
Помимо этого, в экспериментах была наглядно показана различная экспрессия Р-450SCC и Р-450-17a цитохромов в яичнике после лютеинизации, демонстрируя увеличение экспрессии Р-450SCC и снижение экспрессии Р-450-17a, что является результатом различной экспрессии транскрипционных факторов в клетках желтого тела и тека-клетках, которые отвечают за взаимодействие соответствующих факторов в 59-участке этих генов. [88]
На специальной конференции, посвященной ПКЯ, была представлена классификация поликистозных яичников, где были выделены 2 основные группы ПКЯ - ПКЯ с первичным и вторичным поражением яичников, включая 17 подгрупп:
- дефицит 17-кетостероидредуктазы в яичниках
- дефицит 3-a-гидроксистероиддегидрогеназы
- дефицит 5-4-изомеразы
- дисритмия или остановка фолликулогенеза
- андрогенсекретирующие опухоли яичников
- снижение дофамина
- нарушение метаболизма опиатов
- дефицит ферментов стероидогенеза
- гиперответ к стимуляции АКТГ, преждевременное адренархе
- андрогенсекретирующие опухоли
- резистентность к инсулину (синдром Kahn A, синдром Kahn B, синдром Kahn C)
- нарушенная продукция генов (ненормальный инсулин)
- нарушение синтеза инсулиновых рецепторов
- ожирение.
Приведенная выше классификация во многом является спорной. Некоторые из предложенных подгрупп являются гипотетическими.
Согласно биклеточной теории Falk, синтез эстрогенов осуществляется в два этапа в двух группах клеток: в theca interna follikuli синтез осуществляется в основном до уровня Т и андрогенов, а ароматизация их в эстрогены происходит в гранулезе. В фолликулах здоровых женщин и женщин с ПКЯ клетки гранулезы имеют одинаковую ароматазную активность и ароматизируют Т и андрогены до эстрадиола и эстрона в равных количествах. Ароматазная активность клеток гранулезы находится под контролем гипофизарного ФСГ. [114, 127] Избыточное образование Т и андрогенов происходит в малых зреющих фолликулах, не достигших 6 мм в диаметре, т.к. в этих фолликулах клетки гранулезы еще не достигли зрелости и не проявилась ароматазная активность.
Медуллярная часть яичника является остатком тестикулярной части зародышевых гонад. У мужчин эта ткань преобразуется в яички, а у женщин она первично развивается, как и у мужчин, но затем атрофируется, когда вокруг нее образуется кора яичника. Обосновывая это положение, была выдвинута теория, заключающаяся в том, что по каким-то причинам, возможно генетическим, у больных с синдромом Штейна-Левенталя в мозговом слое яичников имеется ткань, которая продуцирует избыток андрогенов. [1]
Необходимо акцентировать внимание на некоторых аспектах продукции андрогенов и их эффекте. У мужчин часто имеется такой уровень андрогенов, что тонкие нюансы воздействия этих гормонов не отмечаются. Однако, у женщин вариабельность действия андрогенов проявляется значительно сильнее. Физиологические реакции на избыточное образование андрогенов в организме отличаются у разных индивидов и зависят от многих факторов. Была сделана попытка выделить основные принципы, необходимые для того, чтобы рассматривать ПКЯ как заболевание. Когда синдром был выявлен впервые, было описано большое количество симптомов, связанных с избыточной продукцией андрогенов. Как примеры были рассмотрены наличие угрей и нарушение менструального цикла. Различная чувствительность к андрогенам у разных женщин приводит к тому, что эти симптомы трудно изучать, даже если предположить единый генетический дефект. [128, 135, 136, 141] Система цитохром Р-450 в яичнике, конвертирующая прогестерон в эстроген и андроген, является высоко- и тонкорегулируемой. Продукция матричной РНК, контролирущая синтез протеина, необходима для продукции ферментов цитохрома Р-450 и плотно взаимодействует с овуляцией.
Еще одним важным патогенетическим звеном при вирилизации у женщин является изменение связывания андрогенов ТЭСГ. Перенос гормонов из их источника к месту назначения происходит в связанном виде. ТЭСГ синтезируется в печени, его молекулярный вес - около 100000. Андрогены и ДЭА не связываются ТЭСГ. Концентрация ТЭСГ в плазме взрослых женщин в два раза выше, чем у мужчин. Это различие вызвано тем, что его продукция стимулируется эстрогенами и подавляется андрогенами. Поэтому женщины с гиперандрогенией имеют более низкую концентрацию ТЭСГ, чем здоровые женщины. Степень биологически активных андрогенов определяется уровнем свободных стероидов. [109, 120]
Синтез андрогенов в яичниках происходит в основном в интерстиции и тека-ткани. [69, 113] Гиперпродукцию андрогенов в яичниках можно объяснить гиперплазией тека-ткани, которая происходит под влиянием двух основных факторов.
Первый фактор - это повышенный базальный уровень ЛГ.
Второй фактор - повышенный уровень инсулина или ИПФР, т.к. гиперинсулинемия при ПКЯ может усиливать эффект ЛГ на теку и строму и, следовательно, вызывать гиперандрогению, которая подавляет положительный механизм эстрогенной обратной связи и контроля ЛГ-секреции. С другой стороны, высокие уровни инсулина могли прямо усилить или подавить положительные эстрогенные ответы механизма обратной связи при ПКЯ. [110, 115] Корреляция между уровнем инсулина, гиперплазией тека-ткани и уровнем андрогенов в крови достаточно хорошо установлена. [69, 111, 115] Возможность существенного влияния гиперандрогении на возникновение и/или поддержание инсулинорезистентности исключается. [111, 115]
Таким образом, при ПКЯ гиперпродукция андрогенов овариального происхождения обусловлена, прежде всего, присутствием в яичниках избыточных количеств андрогенпродуцирующих клеток вследствие их персистенции при кистозной и фиброзной атрезии фолликулов. Значительный вклад в гиперпродукцию андрогенов овариальной тканью вносят стромальные текальные клетки очагов текоматоза, что доказано и иммуногистохимически. Склеротические изменения, наблюдающиеся в яичниках больных с ПКЯ (склероз белочной оболочки, межуточной ткани, стенок сосудов), носят вторичный характер. Они, как и вирильные проявления заболевания, обусловлены гиперандрогенией и являются ее проявлением.
При СПКЯ у 30% пациенток обнаруживается гиперпролактинемия, что может быть, по-видимому, обусловлено снижением количества дофамина в гипоталамусе, который является агонистом пролактинингибирующего фактора, а также со стимулирующим действием эстрогенов на лактотрофы гипофиза. Повышенное содержание пролактина усугубляет имеющуюся гиперандрогению при ПКЯ за счет увеличения адренальных андрогенов и изменения метаболизма овариальных андрогенов.
КЛИНИКА
Описанные в 1935 году Штейном и Левенталем три характерных симптома (аменорея, ожирение, гирсутизм) позднее не были признаны характерными для всех больных. [155] Следует отметить, что уже авторы описанного синдрома говорили о том, что нет ни одного морфологического признака, который был бы ответственен за какой-либо клинический симптом. Гистологическую картину авторы признавали весьма вариабельной. По их словам, ни один из признаков не был стабильным, кроме наличия фолликулярных кист, выстланных текальными клетками. Заслуживают внимания сводные данные из 187 публикаций, собранные J.W. Goldzieher. При суммировании результатов клинических наблюдений за 1079 пациентками с ПКЯ автор установил, что частота всех клинических симптомов варьирует в очень широких пределах. По частоте обнаружения симптомы располагались следующим образом: бесплодие (35-94%), гирсутизм (17-83%), аменорея (15-77%), ожирение (16-49%), дисфункциональные маточные кровотечения (6-55%), наличие желтого тела (0-71%), вирилизация (0-28%), двухфазная базальная температура (12-40%). В соответствии с анализом Голдзиера 63% из 640 женщин, которым была сделана клиновидная резекция яичников, забеременели. [123]
Анализ этих показателей свидетельствует о том, что нет ни одного клинического симптома, который был бы абсолютно патогномоничным для ПКЯ. По мнению большинства клиницистов, наиболее вероятными клиническими признаками ПКЯ являются бесплодие, ановуляция, гирсутизм и нарушение ритма менструаций при характерных результатах биопсии яичников.
Многочисленные публикации за последние 60 лет убеждают, что ПКЯ являются конечным анатомическим субстратом различных воздействий, нарушающих циклические процессы в яичниках и мешающих им выполнять функцию "биологических часов". Отсутствие овуляции является одновременно и причиной и следствием нарушений циклической функции ГГЯС.
Поликистозные изменения в яичниках находят у больных при различных заболеваниях: при бесплодии, а также отсутствии такового, при аменорее, маточных кровотечениях, при значительном увеличении яичников и в яичниках нормальных размеров, при уменьшенных и нормальных размерах матки, при ожирении, различной выраженности гирсутизма. Вполне очевидно, что пациентки с ПКЯ относятся к гетерогенной группе заболеваний. [1, 9, 17, 26]
Синдром ПКЯ встречается относительно редко (1,4-3% из общего числа гинекологических больных или 1,3-8,5% из числа женщин с бесплодием). [108, 116] По данным Б.И. Железнова [29] за 30 лет установлен диагноз "истинных" ПКЯ у 180 больных. В.Н. Серов и Л.Г. Тумилович провели анализ структуры заболеваемости и выявили 8,83% больных с первичными ПКЯ (104 из 1232 больных за 1976-1977 гг). [62] Rai и соавторы за 11 лет (1964-1975 гг) диагностировали типичную форму ПКЯ только у 101 больной, Л.В. Петухова за 10 лет обследовала 78 больных, Cycler с соавторами за этот же период выделил из 428 женщин с подозрением на синдром Штейна-Левенталя всего 29 больных, отвечающих диагностическим критериям этого заболевания. [55]
Ряд авторов разделяют всех больных с ПКЯ на 3 формы:
I - типичная форма ПКЯ или синдром Штейна-Левенталя (овариальная гиперандрогения - патогенетически обусловленная первичным ферментативным дефектом яичниковых 19-гидроксилазных и 3-b-ол-дегидрогеназных систем).
II - сочетанная форма овариальной и надпочечниковой гиперандрогении.
III - больные ПКЯ центрального генеза с разной степенью выраженности симптомов гипоталамо-гипофизарных нарушений. [35, 42, 63]
Выявлены также другие 3 формы: 1. Типичная клиника. 2. Формирующиеся ПКЯ, меньше выраженность и типичость симптомов и лучше поддается лечению. 3. Гипоталамо-гипофизарные расстройства. Появление типичных симптомов после стресса. Эффект лечения преходящ. [12]
Однако до последнего времени нет убедительных доказательств в пользу первичных ферментативных дефектов овариальной ткани. Надпочечники практически всегда играют значительную роль в генезе ПКЯ (инициирующая роль надпочечников в адренархе, либо их вовлечение в патогенез в последующем). III тип синдрома ПКЯ (центрального генеза) имеет расплывчатые клинико-гормональные параметры, кроме того, практически всегда существуют центральные и вегетативные нарушения при типичном СПКЯ I типа. [37, 38, 46]
Симптомы ПКЯ появляются в позднем препубертатном и пубертатном периодах. Ожирение и гирсутизм возникают до менархе, а нарушения менструального цикла начинаются с первой менструации. Однако, ретроспективное установление времени начала прибавки массы тела и усиления роста волос часто затруднено из-за постепенного прогрессирования процессов. [73, 74, 119]
Гирсутизм и ожирение не являются обязательными спутниками ПКЯ, встречаясь соответственно, в 56-88% и 43-82% наблюдений по данным разных авторов, а нарушения менструального цикла встречаются при ПКЯ в 80-100% случаев. [13, 21, 28] При данной патологии может иметь место спонтанная овуляция, однако, вероятность ее мала. [86] Даже при отсроченном появлении симптомов ПКЯ патологическое функционирование репродуктивной системы начинается с препубертатного периода. Время декомпенсации репродуктивной системы зависит, очевидно, от степени выраженности ее несостоятельности и от воздействия экзогенных факторов (физическое и психическое перенапряжение, инфекционные заболевания). [26, 120]
Для больных с ПКЯ характерен женский морфотип, молочные железы у них развиты правильно, без признаков гипоплазии. Ожирение (по данным разных авторов) встречается у 30-55% больных с ПКЯ. [5, 32, 106] Наличие этого симптома не безразлично, т.к. замечено, что даже при алиментарном ожирении наблюдаются различные нарушения менструального цикла и выявляются морфологические нарушения в яичниках. Многие авторы отмечают у женщин с ПКЯ сочетание ожирения с симптомами гипоталамо-гипофизарных нарушений: розовые и белые стрии на коже, повышение внутричерепного и артериального давления, изменения на ЭЭГ и т.д. О гипоталамическом характере поражения при ожирении свидетельствуют клинические наблюдения, говорящие о том, что вентромедиальные ядра гипоталамуса являются и центрами насыщения, и их повреждение вызывает ожирение.
Обнаружено, что у пациенток с ожирением уровень ЛГ в сыворотке почти вдвое выше, а ТЭСГ значительно ниже, чем у женщин контрольной группы, имеющих нормальную массу. Между содержанием ТЭСГ и массой тела выявлена положительная корреляционная связь (r=0,62, р<0,05). [26, 109]
При уменьшении содержания ТЭСГ повышается уровень свободного тестостерона, что тормозит созревание фолликулов и оказывает непосредственное влияние на функцию яичников. С повышением объема жировой ткани увеличивается содержание свободного тестостерона, и возрастает превращение андрогенов в жировой ткани в эстрогены, что, в свою очередь, увеличивает секрецию ЛГ и подавляет продукцию ФСГ. [59, 72]
Однако, не у всех женщин с ожирением формируются ПКЯ, поэтому изменения содержания ТЭСГ нельзя считать первичной и единственной причиной ПКЯ. Снижение уровня ТЭСГ может быть дополнительным фактором в развитии ПКЯ у пациенток с ожирением. Ожирение часто развивается в пре- или постпубертатном периоде или совпадает с менархе [73], и, возможно, является одним из механизмов, ответственных за развитие ПКЯ, в связи с увеличением экстрагландулярной ароматизации андрогенов.
Что касается другого важного клинического признака ПКЯ - гирсутизма, то степень выраженности его варьирует в широких пределах и не коррелирует с уровнем свободных андрогенов в сыворотке крови, что, по-видимому, связано с чувствительностью андрогеновых рецепторов в волосяных фолликулах.
Для оценки ожирения определяется индекс массы тела по Bray по формуле: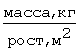 .
В норме индекс массы тела равен 19-25. Индекс от 26 до 30 говорит о низкой
вероятности возникновения метаболических осложнений, свыше 30 - о средней
степени риска, свыше 40 - о высокой степени риска развития метаболических
осложнений.
.
В норме индекс массы тела равен 19-25. Индекс от 26 до 30 говорит о низкой
вероятности возникновения метаболических осложнений, свыше 30 - о средней
степени риска, свыше 40 - о высокой степени риска развития метаболических
осложнений.
Для выявления степени выраженности гирсутизма определяется гирсутное число по шкале Ferriman, Gallwey. В норме у 96% здоровых женщин гирсутное число не превышает 7 баллов.
ДИАГНОСТИКА
Диагностика ПКЯ достаточно сложна.
1. Двуручное гинекологическое исследование. Увеличенные, плотные баллотирующие и скользящие под рукой яичники с гладкой поверхностью. [12]
2. В настоящее время одним из точных методов диагностики ПКЯ является УЗИ органов малого таза. Гипердиагностика СПКЯ при УЗИ - 20%.
Неинвазивный характер УЗИ позволяет выполнить повторные обследования и наблюдать за реакцией яичников на терапевтические воздействия. Однако, по данным УЗИ более чем у 90% больных с гирсутизмом неясного генеза выявлены кистозные изменения в яичниках. Поэтому необходимо дифференцировать ПКЯ от других состояний, приводящих к кистозному изменению в яичниках. У больных с ПКЯ яичники увеличены за счет сильно эхогенной стромы, в которой расположены, преимущественно по периферии, множественные кисты диаметром 2-4 мм. [103, 112]
Ряд авторов рекомендует определять следующие признаки: объем яичников, максимальная поверхность, эхогенность, наличие кист яичников, их количество и размер, край яичника, ровный либо неровный, утолщение капсулы яичников. [20, 117]
Демидов В.Н. и соавторы предлагают для увеличения точности диагностики применять яичниково-маточный индекс - отношение объема яичников к толщине тела матки. При повышении этого показателя более 3,5 с большой долей вероятности можно предполагать СПКЯ, а при увеличении яичниково-маточного индекса более 5,0 - синдром Штейна-Левенталя. Введение числовых критериев позволяет повысить точность неинвазивной диагностики ПКЯ до 88%. [22, 139]
Однако, в силу субъективных и объективных особенностей УЗИ не стал абсолютным стандартом в диагностике ПКЯ. Неправильная постановка диагноза по УЗИ по множественным данным колеблется в пределах от 18 до 47%, при этом в равной степени имеется как гипердиагностика, так и недооценка ультразвуковых признаков заболевания. [23, 54, 112]
Результаты ультрасонографического исследования позволили определить признаки, характерные для больных с ПКЯ:
- яичниково-маточный индекс более 3,5,
- уменьшение передне-заднего размера матки,
- увеличение объема яичников,
- множественные кистозные фолликулы, которые расположены не по периферии, а в паренхиме железы.
Надежную информацию можно получить при вычислении яичниково-маточного индекса, который в норме не превышает 3,5. При СПКЯ яичниково-маточный индекс более 3,5.
ЯМИ =
![]() ,
где ЯП (Д,Т,Ш) и ЯЛ (Д,Т,Ш) соответствуют длине, толщине и ширине правого и
левого яичников, Мт - толщина матки.
,
где ЯП (Д,Т,Ш) и ЯЛ (Д,Т,Ш) соответствуют длине, толщине и ширине правого и
левого яичников, Мт - толщина матки.
При исследовании яичников выясняли их размеры и объем, который вычисляли по формуле Д*Т*Ш*0,5 см3.
Капсула яичников определяется как гиперэхогенное образование, утолщенной считали капсулу более 5 мм.
3. В последнее время у больных с ПКЯ широко применяется лапароскопия с диагностической и лечебной целью. Макроскопическая картина ПКЯ при лапароскопии имеет некоторые особенности. Яичник, как правило, вытянутой формы и в 1,5-2 раза превышает размеры нормального яичника, с гладкой жемчужно-белой капсулой или оболочкой, а не шероховатой, в связи с отсутствием "шрамов" от предшествующих овуляций. Увеличение яичников билатеральное, симметричное, редко - унилатеральное или асимметричное. У небольшого числа больных размеры яичников не превышают нормы. [6, 4]
Поликистозные яичники имеют большую плотность по сравнению с нормальными яичниками. Белочная оболочка утолщена в 8-15 раз как результат избытка андрогенов и гибели фолликулярного аппарата за счет дистрофических изменений. Толщина капсулы может достигать 500-600 нм. Есть данные о корреляции между выраженностью гиперандрогении и толщиной белочной оболочки при ПКЯ. В корковом слое в большинстве случаев сохраняется свойственное возрасту число примордиальных фолликулов. Встречаются и фолликулы на разных стадиях созревания. Кистозной атрезии чаще всего подвергаются антральные фолликулы. Часть зреющих фолликулов, как и кистозно измененных, проходят и фазу фиброзной атрезии, но реже, чем у здоровых женщин. Основная масса кистозно атрезирующих фолликулов персистирует. Атрезированные фолликулы характеризуются гиперплазией текальной ткани, которая, по мнению большинства исследователей, является одним из наиболее отличительных признаков ПКЯ. [1, 29, 125] Персистенция кистозно измененных фолликулов обусловливает наряду с гипертрофией коркового слоя и утолщением белочной оболочки увеличение массы и размеров яичников. Корковое и мозговое вещество, как правило, содержит избыток фиброзной ткани, но выраженность склероза вариабельна. [29]
В процессе кистозной атрезии фолликулярный эпителий дегенерирует и слущивается, в результате основная масса таких фолликулов лишена слоя гранулезы. Исключение составляют кистозные фолликулы с недостаточно дифференцированной внутренней оболочкой: в них всегда сохраняется до 2-3 рядов фолликулярных клеток.[1, 69]
Совокупность морфологических признаков, выявляемых при лапароскопическом исследовании, позволяет с высокой точностью верифицировать диагноз СПКЯ. Среди них выделяют абсолютные и относительные лапароскопические признаки СПКЯ (по данным Э.А. Алиевой, 1991 г.).
Абсолютными признаками являются: гладкая натянутая белочная оболочка с сосудистым рисунком на поверхности; наличие 10 и более подкапсульных кист (диаметром 0,1-1,2 см).
Относительными, но часто встречающимися признаками являются: уменьшение переднезаднего размера тела матки; двустороннее увеличение яичников; утолщенная плотная капсула яичника; отсутствие желтого тела; отсутствие свободной перитонеальной жидкости.
У больных с синдромом Штейна-Левенталя отмечается несколько иная лапароскопическая картина: уменьшение всех размеров тела матки; значительно увеличенные яичники (в 3-4 раза); плотная капсула, через которую не просвечивают подкапсулярно расположенные кистозно-атретические фолликулы.
Лапароскопия в диагностике ПКЯ и сочетанной патологии органов малого таза:
|
Патология органов малого таза |
Частота |
|
Сочетанная патология органов малого таза |
58% |
|
Трубно-перитонеальное бесплодие (следствие лапаротомии и клиновидной резекции яичников) |
32% |
|
Спаечный процесс и трубно-перитонеальное бесплодие (следствие сальпингита) |
20% |
|
Пороки развития матки (двурогая, однорогая, седловидная, неполная перегородка) |
9% |
|
Фиброма яичника |
7,1% |
|
Миома матки (до 2 см) |
6,5% |
|
НГЭ (I ст. во всех наблюдениях) |
3,2% |
При бимануальном исследовании у некоторых можно выявить:
- двустороннее увеличение яичников - 31,6%
- одностороннее увеличение - 25,2%
- у 43,2% яичники не пальпировались.
По данным гистохимических исследований в яичниках больных с синдромом Штейна-Левенталя выявляются те же ферменты, обеспечивающие биосинтез стероидов, что и в яичниках здоровых женщин, а именно - 3b-оксистероид-дегидрогеназа, глюкозо-6-фосфат-дегидрогеназа, алкоголь-дегидрогеназа и др. Активность их вполне сопоставима с активностью соответствующих ферментов в яичниках здоровых женщин.
Размеры яичников при ПКЯ в значительной мере определяются размерами неовулировавших персистирующих фоликулов (морфологическое содержание поликистоза) и гиперплазированной стромой. Можно предположить, что размеры фолликулов зависят от стимуляции фолликулогенеза ФСГ и торможением их роста (повышенным уровнем андрогенов и ингибина). Выраженность гиперплазии тека-ткани зависит от стимуляции ЛГ и инсулина (или других инсулиноподобных факторов). При этом величина яичников коррелирует с уровнем гонадотропинов. Можно утверждать, что хроническая ановуляция любого генеза, сочетающаяся с достаточным уровнем гонадотропинов и/или инсулина (инсулиноподобных факторов роста), может привести к кистозным изменениям в яичниках и гиперандрогении. [1, 69, 97]
Характерные лапароскопические признаки ПКЯ
двустороннее увеличение яичников
гладкая, утолщенная капсула с сосудистым рисунком разной степени выраженности
наличие подкапсулярных кист и мелких кист на разрезе в яичниках
отсутствие свободной перитонеальной жидкости.
Лапароскопия также позволяет установить сочетание ПКЯ с другой патологией органов малого таза.
Патология органов малого таза у больных СПКЯ
|
Спаечный процесс и трубно-перитонеальное бесплодие вследствие лапаротомии |
32% |
|
Спаечный процесс и трубно-перитонеальное бесплодие вследствие сальпингита |
20% |
|
Миома матки |
6,5% |
|
Наружный генитальный эндометриоз |
3,2% |
|
Пороки развития матки |
9% |
|
Фиброма яичника |
7% |
3. Определенную диагностическую ценность имеет исследование гормонального статуса больных с ПКЯ. Характерная особенность гормональных взаимоотношений при ПКЯ - отсутствие цикличности в продукции гонадотропных и половых гормонов. Одним их основных звеньев патогенеза при данном заболевании является повышенная секреция ЛГ и снижение образования ФСГ в гипофизе, при этом значительно, более, чем в 2,5 раза, возрастает соотношение ЛГ/ФСГ. Что касается уровня пролактина, то он может быть повышен в 30% случаев и сопровождаться галактореей. При гиперпролактинемии для решения вопроса о целесообразности назначения парлодела у больных с ПКЯ необходимо исследовать уровень пролактина в сыворотке крови.
По результатам гормонального обследования больных с ПКЯ характерными признаками являются:
- концентрация прогестерона, отвечающая параметрам ановуляторного цикла,
- повышенный индекс ЛГ/ФСГ более 2,5,
- повышенный уровень тестостерона,
- сниженный уровень эстрадиола.
Уровень экскреции 17-КС с мочой не превышал норму в 87% наблюдений.
У всех пациенток с ПКЯ по данным ЭЭГ выявлены выраженные признаки дисфункции стволовых и диэнцефальных структур.
Таким образом, у больных с ПКЯ обнаружена ацикличность функции репродуктивной системы, в основном по типу олигоменореи, активирована гонадотропная функция гипофиза, а стероидогенетическая функция яичников подавлена.
Синтез половых гормонов у больных с ПКЯ также значительно нарушен. Прежде всего это касается андрогенов и в первую очередь Т, уровень которого в большинстве случаев повышен. Количество андростендиола также несколько больше нормы. Иногда при ПКЯ отмечается увеличенный уровень ДЭА-С, являющегося преимущественно андрогеном надпочечникового происхождения. Данный факт нуждается в объяснении, так как количество АКТГ при ПКЯ находится в пределах нормы. Некоторые исследователи допускают, что повышенная концентрация ДЭА-С может быть связана с повышением уровня эстрона. Известно, что эстрогены могут ингибировать энзим 3b-ол-дегидрогеназу и повышать чувствительность ДЭА-С к АКТГ у больных с ПКЯ, что сопровождается усилением секреции ДЭА-С надпочечниками. Это необходимо учитывать при назначении кортикостероидной терапии в процессе лечения больных с ПКЯ. Несмотря на гиперандрогению, количество экскретируемых 17-КС может быть в пределах нормы или слегка повышенным. Из-за отсутствия желтого тела яичников уровень прогестерона резко снижен по сравнению с таковым при нормальном менструальном цикле.
Имеет диагностическое значение исследование функции коры надпочечников в условиях стимуляции АКТГ. Человеческая популяция подразделяется на носителей и неносителей дефектного гена 21-гидроксилазы. Первые составляют 67% больных СПКЯ, вторые - 33%. Базальные уровни 17-ОПК, ДЭА и кортизола у обеих групп одинаковы. Через 24 после стимуляции АКТГ уровни 17-ОПК и ДЭА остаются повышенными у носителей (недостаточность ферментов), что создает условия для развития гиперандрогении. Кроме того, у носителей реже наблюдаются нарушения менструальной функции, более позднее наступление менархе, часть из них успевает забеременеть и родить, в то время как у неносителей преобладает первичное бесплодие.
Разработана дифференцированная оценка результатов пробы с АКТГ [67]. Для этого введен параметр D. Чем больше значение D, тем больше выражена ферментная недостаточность, позже наступит менархе, раньше разовьются нарушения менструальной функции, больше вероятность невынашивания беременности. При D>0,049 можно говорить о носительстве мутации гена 21-гидроксилазы (стертая вирильная форма АГС, дисфункция коры надпочечников). Частота гетерозиготного носительства этого гена среди авциенток с гиперандрогенией и СПКЯ составляет 63,2%. Общепринятые методики обследования больных с СПКЯ не позволяют выявить гетерозиготное носительство мутации. Все носители могут быть разделены на три группы в зависимости от степени выраженности мутации: 1 группа - D = 0,049 - 0,5; 2 группа - D = 0,5 - 0,9; 3 группа - D ³ 1.
Нарушения стероидогенеза в коре надпочечников могут быть следующих типов: гиперфункция коры надпочечников или ее дисфункция. При гиперфункции коры надпочечников после пробы с АКТГ D понижен. При дисфункции наблюдается гетерозиготное ностиельство мутантного гена, D повышен. Соответственно дифференцируется терапия.
При положительной пробе с АКТГ, наличии дисфункции коры надпочечников проводится заместительная гормональная терапия. Преднизолон по 2,5-10 мг в сутки в течение 3-6 месяцев под контролем ТФД. Эффективность лечения - 30%. После этого проводится индукция овуляции - еще 30% эффективности.
Второй группе женщин - с гиперфункцией коры надпочечников, высокими уровнями АКТГ и кортизола исходно, при отрицательной пробе с АКТГ проводится терапия, направленная на нормализацию отношений в гипоталамо-гипофизарно-яичниковой системе. Дифенин, ноотропная терапия - 3-6 месяцев. Эффективность 30%. Последующая стимуляция овуляции эффективна в 20%.
Большое значение имеет раннее выявление больных, диагностика формы СПКЯ и дифференцированное лечение (желательно проводить с пубератата - без стимуляции овуляции). 36,6% женщин-носителей недостаточности 21-гидроксилазы имели спонтанные беременности, а нарушения менструального цикла у них были менее тяжелыми, чем у пациенток-неносителй. Раннее назначение глюкокортикоидной терапии (патогенетическое лечение) позволило бы созранить репродуктивную функцию у этого контингента больных [67].
Для уточнения диагноза ПКЯ и оценки чувствительности периферических гормонов к влиянию гипоталамических факторов их регуляции возможно проведение пробы с люлиберином. У больных с ПКЯ введение люлиберина способствует более выраженному увеличению концентрации ЛГ (в 4-7 раз), чем концентрации ФСГ (в 1,5-3 раза). Повышение чувствительности ЛГ к люлиберину при незначительной реакции ФСГ является признаком, характерным для ПКЯ.
Для выявления источника гиперандрогении проводят дексаметазоновую пробу. Она основана на способности дексаметазона (как и всех глюкокортикоидных препаратов) подавлять выделение АКТГ передней долей гипофиза, вследствие чего тормозится образование и выделение андрогенов надпочечниками. Пробу оценивают по снижению содержания в плазме крови тестостерона, 17-ОНП и ДЭА, а в суточной моче - 17-КС. При снижении названных показателей по сравнению с исходными более чем на 50-75% проба считается положительной, что указывает на надпочечниковый источник андрогенов. Снижение после пробы менее чем на 30-25% указывает на яичниковое происхождение андрогенов.
Существует балльная шкала диагностики СПКЯ (Гаспаров А.С.). Общая сумма клинических признаков составляет 28 баллов, гормональных - 23, ультразвуковых - 29, лапароскопических - 35, морфологических - 21. Диагностическая сумма баллов = 50. Таким образом, диагноз можно поставить и без морфологического исследования.
4. Гистологическое исследование соскоба эндометрия у женщин с ПКЯ выявляет пролиферацию. Однако, ряд авторов указывает на определенную частоту гиперпластических изменений эндометрия, вплоть до обнаружения железисто-кистозной гиперплазии и полипоза эндометрия. [41, 63]
Сведения о возникновении гиперплазий и аденокарциномы эндометрия у больных с ПКЯ появились давно, однако, данные о частоте их весьма противоречивы. Частота гиперпластических процессов эндометрия у таких больных варьирует от 20 до 50% и выше, частота рака от 1 до 25%. В последние годы больных с ПКЯ стали относить в группу риска, как расположенных к предраку и раку эндометрия. [41, 63]
В наблюдениях Б.И. Железнова (1982г) частота гиперплазий эндометрия у больных с истинными склерокистозными яичниками составила 19,5%, аденокарциномы - 2,5%. Такая частота гиперплазий эндометрия хотя и является высокой, однако все же ниже той, которая приводится в литературе. Очень высокая частота гиперплазий (это относится и к раку эндометрия) при ПКЯ, о которой сообщают отдельные авторы, в основном объясняется фактом включения в "синдром ПКЯ" не только истинных склерокистозных яичников, но и других заболеваний. [29, 63]
Формирование гиперпластических процессов эндометрия на фоне ПКЯ общепризнано, но в последние годы появились работы, свидетельствующие о возможности сочетания ПКЯ с миомой матки и эндометриозом, которые протекают, в основном, субклинически, и диагноз ставится при операции или лапароскопии по поводу ПКЯ. [42, 63]
Результаты исследования молочных желез при ПКЯ очень противоречивы. В литературе есть сообщения о высоком проценте инволютивных процессов у большинства больных ПКЯ. [9, 16] По мнению других авторов, преобладают гиперпластические процессы в молочных железах (56% больных).
ЛЕЧЕНИЕ БОЛЬНЫХ С СИНДРОМОМ ПОЛИКИСТОЗНЫХ ЯИЧНИКОВ
Лечение ПКЯ в значительной степени зависит от возраста больной. У девушек и молодых женщин, не стремящихся забеременеть, терапия должна быть направлена на нормализацию менструального цикла, а также на профилактику гиперпластических процессов в органах-мишенях: эндометрии и молочных железах. С этой целью используют гестагены (норколут, прогестерон) за 8-10 дней до начала менструации. Подобная терапия позволяет сформировать искусственный менструальный цикл и препятствует возникновению гиперпластических процессов в эндометрии.
У женщин репродуктивного возраста, заинтересованных в беременности, терапия ПКЯ должна быть направлена на восстановление нарушенной репродуктивной функции. Добиться наступления беременности при ПКЯ можно путем индукции овуляции, для чего существуют два основных метода: консервативный - назначение прямых и непрямых стимуляторов овуляции и оперативный. Перед началом лечения необходимо произвести диагностическое выскабливание слизистой матки для исключения атипической гиперплазии эндометрия.
В последние годы общепринято начинать лечение больных с ПКЯ с проведения консервативной терапии. Наиболее эффективным и распространенным является назначение кломифенцитрата, механизм действия которого заключается в блокаде эстрогенных рецепторов на уровне гипоталамуса, что приводит к нормализации выброса ЛГ и ФСГ.
Беременность при лечении кломифеном, как правило, наступает на первых курсах. Используется схема, при которой назначение кломифена сочетается с использованием ХГ. В данном случае необходим контроль (гормональный и ультразвуковой) для наблюдения за ростом фолликула и определения времени назначения ХГ. [116]
Если при такой терапии овуляция не наступает, то дополнительно к кломифенотерапии назначают пергонал по индивидуально подобранной схеме. Известны различные схемы стимуляции овуляции гонадотропинами. В данном случае большой опасностью является развитие синдрома гиперстимуляции и многоплодной беременности, которая нередко заканчивается самопроизвольным выкидышем. Многие авторы считают, что вышеуказанный тип терапии не является патогенетическим для больных с ПКЯ.
Патогенетически более обоснована стимуляция овуляции с помощью чистого ФСГ - метродина. В схему стимуляции чистым ФСГ, так же как и кломифеном, можно включать ХГ под контролем УЗИ при достижении фолликулом размера не менее 16 мм.
В последние годы участились сообщения об успешном применении при стимуляции овуляции у больных ПКЯ аналогов ГТ-РГ, хотя авторы отмечают отсутствие изменения характера заболевания в результате терапии и не считают ее патогенетической.
При наличии надпочечникового компонента гиперандрогении у больных с ПКЯ обоснованной является терапия кортикостероидными препаратами под контролем экскреции 17-КС. На фоне этой терапии следует проводить стимуляцию овуляции либо консервативным методом (назначение кломифена), либо хирургическим (КРЯ).
Больным с ПКЯ в сочетании с гиперпролактинемией целесообразно назначение парлодела в дозах 5-7,5 мг/сутки в зависимости от уровня пролактина в сыворотке крови. Введение данного препарата приводит к снижению уровня ЛГ, тестостерона, уменьшению соотношения ЛГ/ФСГ, нормализации ответа ЛГ на ГТ-РГ. Подобная терапия проводится до нормализации уровня пролактина, после чего возможно назначение стимуляторов овуляции, либо оперативное вмешательство на ПКЯ.
После длительной неэффективной гормональной терапии необходимо решать вопрос об оперативном вмешательстве.
Механизм положительного эффекта операции до настоящего времени еще недостаточно изучен, но большинство исследователей склонно считать, что удаление патологически измененной ткани яичника приводит к снижению андрогенов в организме. Это подтверждено исследованиями, в которых определяли концентрацию андрогенов до и после операции.
Другая гипотеза, связанная с положительным эффектом операции, основана на том, что снижение концентрации эстрогенов в крови происходит в меньшей степени, чем андрогенов. Восстановление овуляторного цикла, возможно, связано с превалирующим действием эстрогенов над андрогенами, которые, как известно, повышают чувствительность яичников к гонадотропинам.
После операции происходит снижение содержания ЛГ в крови, что приводит к нормализации соотношения ЛГ и ФСГ и создает условия для овуляции. [24]
Оперативная лапароскопия у больных с ПКЯ:
|
Виды операции |
Число |
|
КРЯ |
64% |
|
Каутеризация яичников монополярным коагулятором |
26% |
|
Каутеризация яичников аргоновым лазером |
7,5% |
|
Сальпингоовариолизис |
54% |
|
Сальпингостомия |
9% |
|
Фимбриопластика |
6,5% |
|
Миомэктомия |
6,5% |
|
Коагуляция очагов эндометриоза |
3,5% |
Эффективность каутеризации яичников манополярным коагулятором - 45%, аргоновым лазером - 47%.
Существуют различные виды хирургического вмешательства на ПКЯ: односторонняя овариэктомия, экстравертирование, демедулляция, декортикация, однако методом выбора является клиновидная резекция яичников (КРЯ). Ранее эта операция осуществлялась путем лапаротомии, однако в настоящее время разработан новый подход к хирургическому лечению больных с ПКЯ - методом оперативной лапароскопии. Перспективным хирургическим лечением больных с ПКЯ следует считать эндоскопическую резекцию ПКЯ, а также применение термокаутеризации и электрокоагуляции яичников во время лапароскопии. Огромным преимуществом этого метода перед лапаротомией является значительное снижение частоты возникновения в дальнейшем перитонеальной формы бесплодия. Частота восстановления менструальной функции после операции составляет 70-86%, детородной - 37-60%. Наибольшая частота наступления беременности (73%) наблюдается в первые 6 месяцев после операции.
Данные катамнеза: через 2-18 лет у 79% женщин после наступившей беременности рецидивировали симптомы заболевания, развилась стойкая ановуляция, гиперпластические процессы эндометрия. У 21% произошло полное восстановление двухфазного цикла, отмечались спонтанные беременности, нормализовалась ультразвуковая картина. Преимущественно выздоровление наблюдалось у молодых женщин с недлительным течением болезни и слабо выраженными симптомами.
список использованной литературы
1. Акопян С.С., Мириманова Р.П., Муродян А.Г. Морфоструктурные особенности овариальной ткани у больных, страдающих различными клиническими формами синдрома поликистозных яичников. //Современные вопросы репродуктологии. -Тбилиси, 1988. -С.103-104.
2. Алексеева М.Л., Алиева Э.А., Корсаков С.Г., Новиков Е.А., Фанченко Н.Д. Изучение импульсного характера секреции гонадотропинов при синдроме поликистозных яичников. //Акуш. и гин. -1991. -№9. -С.54-58.
3. Алиева Э.А. Синдром поликистозных яичников у женщин репродуктивного возраста. //Дисс...докт. мед. наук. -М., 1991г. -366С.
4. Алиева Э.А., Овсянникова Т.В., Пшеничникова Т.Я. Бесплодие, обусловленное синдромом поликистозных яичников. //Акуш. и гин. -1991. -№6. -С.59-62.
5. Алиева Э.А., Фанченко Н.Д., Паршутин Н.П. Эффект снижения массы тела у больных с синдромом поликистозных яичников. //Акуш. и гин. -1993. -№3. -С.33-36.
6. Анохин П.К. Узловые вопросы теории функциональной системы. -М., 1980.
7. Аншина М.Б. История и эволюция методов лечения бесплодия. //Пробл. репрод. -1995. -№1. -С.9-13.
8. Артифаксов С.Б. Андрологические аспекты бесплодного брака. //Акуш. и гин. -1996. -№2. -С.46-88.
9. Атаниязова О.А. Восстановление репродуктивной функции у больных с поликистозными яичниками и гиперпролактинемией. //Дисс...докт. мед. наук. -М., 1987. -117С.
10. Атаниязова О.А., Орлова В.Г., Сметник В.П., Афонина Л.И. Синдром поликистозных яичников с повышенным уровнем пролактина. //Акуш. и гин. -1990. -№4. -С.42-44.
11. Бабичев В.Н. Нейрогормональная регуляция овариального цикла. //-М., 1984. -240С.
12. Бадоева Ф.С. Восстановление репродуктивной функции после расширенной клиновидной резекции склерокистозных яичников. // Автореф. Дисс. . . канд.мед.наук. Москва, 1984. - 24С.
12. Бенедиктов Д.И. Лечение и реабилитация больных синдромом склерокистозных яичников. //Дисс...докт. мед. наук. -Свердловск, -1981. -189С.
13. Бодяжина В.И., Сметник В.П., Тумилович Л.Г. Неоперативная гинекология. //-М., 1990. -543С.
14. Бронштейн М.Э., Зеленецкая В.С. Патофизиологические аспекты гиперандрогенной дисфункции яичников (синдрома Штейна-Левенталя). //Современные вопросы репродуктологии. -Тбилиси, 1988. -С.101-102.
15. Бурдина Л.М., Крымская М.Л., Оганезова М.В., Аксамитова В.П. Клинико-рентгенологическая характеристика состояния молочных желез у больных с поликистозными яичниками. //Акуш. и гин. -1993. -№4. -С.53-55.
16. Вихляева Е.М. О возможных путях разрешения дискуссионных аспектов проблемы синдрома склерокистозных яичников. //Акуш. и гин. -1981. -№7. -С.58-61.
17. Гаспаров А.С., Кулаков В.И. Роль лапароскопии в диагностике болезни поликистозных яичников и сопутствующей патологии органов малого таза. //Пробл. репрод. -1995. -№2. -С.34-35
18. Грозовская Л.В. Современные принципы диагностики и лечения больных поликистозными яичниками. //Дисс...канд. мед. наук. -М., 1984. -107С.
19. Гудкова М.А. Гормональная коррекция менструальной функции как метод терапии климактерического синдрома. //-М., 1994.
20. Давиденкова Е.Ф., Либерман И.В. Клиническая генетика. //-Л., 1975г. -432С.
21. Демидов В.Н., Алиева Э.А., Струков А.В. Возможности эхографии в диагностике синдрома поликистозных яичников. //Акуш. и гин. -1991. -№1. -С.40-42.
22. Добрачева А.Д. Гонадотропная регуляция андрогенной функции яичников при синдроме Штейна-Левенталя. //Автореф. дисс...канд. биол. наук. -М., 1981. -20С.
23. Добротина А.Ф., Качалина Т.С. Влияние хирургического метода лечения синдрома склерокистозных яичников на гонадотропную функцию гипофиза. //Акуш. и гин. -1982. -№11. -С.18-20.
24. Добротина М.С. Диагностическая ценность функциональных проб с гормонами у больных вторичной аменореей центрального генеза. //Акуш. и гин. -1981. -№7. -С.21-23.
25. Долян Г.Г. Гирсутный синдром у женщин детородного возраста. //Автореф. дисс...канд. мед. наук. -М., 1981. -20С.
26. Долян Г.Г., Бунаэян Р.А., Ванецян А.Л., Окоев Г.Г., Авгарян М.Т. Диагностические критерии синдрома поликистозных яичников. //Акуш. и гин. -1989. -№7. -С.26-28.
27. Ефремова Л.Д. Применение препарата дифенин с целью восстановления репродуктивной функции у пациенток с синдромом поликистозных яичников. //Дисс...канд. мед. наук. -М., 1993. -130С.
28. Железнов Б.И. Спорные и неясные вопросы терминологии, морфологии, диагностики и лечения склерокистозных яичников. //Акуш. и гин. -1982. -№2. -С.10-16.
29. Жмакин К.Н. Гинекологическая эндокринология. //-М., 1980. -С.75-77.
30. Здановский В.М., Аншина М.Б., Прилепская В.Н. и соавт. Термокаутеризация склерокистозных яичников во время лапароскопии. //Акуш. и гин. -1987. -№7. -С.52-55.
31. Камилова Д.П. Клиника, диагностика и лечение бесплодия у женщин с галактореей и регулярным ритмом менструаций. //Автореф. дисс...канд. мед. наук. -М., -1995. -21С.
32. Кириллова Е.А. Клинические и генетические аспекты нарушений репродуктивной системы женщины. //Дисс...докт. мед. наук. -М., 1989. -336С.
33. Кирюшкин А.В. Особенности функционального состояния репродуктивной системы и эндокринный статус при некоторых формах женского бесплодия. //Автореф. дисс...канд. мед. наук. -М., 1995. -23С.
34. Костина Т.И. Клинико-патогенетическая характеристика синдрома поликистозных яичников. //Автореф. дисс...канд. мед. наук. -Куйбышев, -1989г. -15С.
35. Колчин А. Психологические аспекты репродукции человека. //Пробл. репрод. -1995. -№1. -С.33-39.
36. Комаров Е.К. Особенности функции коры надпочечников у больных с гиперандрогенией различного генеза. //Акуш. и гин. -1991г. -№12. -С.41-44.
37. Коренева Г.П., Шикаева Ф.В., Ефименко Н.Ф. К патогенезу синдрома склерокистозных яичников. //Акуш. и гин. -1982. -№2. -С.21-24.
38. Костина Т.М. Клинико-патогенетическая характеристика синдрома поликистозных яичников. //Дисс...канд. мед. наук. -М., 1989г.
39. Крымская М.Л. Синдром склерокистозных яичников, диагностика и дифференциальная диагностика. //Акуш. и гин. -1980. -№9. -С.53-56.
40. Кузнецова И.В. Гиперпластические процессы в органах-мишенях у женщин старше 35 лет, подвергшихся клиновидной резекции поликистозных яичников. //Акуш. и гин. -1991. -№2. -С.57.
41. Кузнецова И.В. Состояние репродуктивной системы женщин в отдаленные сроки после клиновидной резекции поликистозных яичников и репродуктивное здоровье их дочерей. //Автореф. дисс...канд. мед. наук. -М., 1991г. -20С.
42. Кузнецова И.В., Стрижаков А.Н. Роль гипоталамического синдрома периода полового созревания в патогенезе поликистозных яичников. //Акуш. и гин. -1996. -№2. -С.7-10.
43. Кулаков В.И., Гаспаров А.С. Болезнь поликистозных яичников: сравнительное изучение эффективности различных видов эндоскопических операций. //Пробл. репрод. -1995. -№2. -С.31.
44. Лоуренс Д.Р., Бенитт П.Н. Клиническая фармакология. //-М., 1991. -С.20, 144-148.
45. Любимова Л.П. Диагностика разных форм синдрома склерокистозных яичников и эффективность хирургического лечения. //Автореф. дисс...канд. мед. наук. -Харьков, -1990. -23С.
46. Мальцева М.А., Пищулин А.А., Бронштейн М.Э. Стромальный текоматоз. //Пробл. репрод. -1995. -№1. С.52-62.
47. Манукян А.Р. Современные аспекты патофизиологии синдрома поликистозных яичников и эффективность эндоскопических методов лечения. //Автореф. дисс...канд. мед. наук. -Ереван, -1992. -24С.
48. Назаренко т.А., Сотникова Е.И., Дуринян Э.Р. Принципы и схемы стимуляции овуляции при бесплодии, обусловленном нарушениями функции гипоталамо-гипофизарной системы. //Акуш. и гин. -1996. -№5. -С.46-50.
49. Никитин А.И., Китаев Э.М., Слзина Н.М., Неронова Е.Г. Нарушение формирования женских гамет и пренатальная патология. //Акуш. и гин. -1990. -№1. -С.45-47.
50. Озол С.А. Клиническое значение сексстероидсвязывающего глобулина при синдроме поликистозных яичников. //Автореф. дисс...канд. мед. наук. -Казань, 1994. -20С.
51. Памфамиров Ю.К., Голубев В.А., Фержаун А. Современные аспекты диагностики синдрома поликистозных яичников. //Акуш. и гин. -1991. -№2. -С.20-23.
52. Пауэрстейн К. Дж. Гинекологические нарушения. Дифференциальная диагностика и терапия. //-М., 1985. -592С.
53. Персианинов Л.С., Демидов В.Ш. Ультразвуковая диагностика в акушерстве и гинекологии. //-М, 1982. -334С.
54. Петухова Л.В. Эффективность оперативного и консервативного лечения больныХ со склерокистозными яичниками. //Автореф. дисс...канд. мед. наук. -М., 1978. -14С.
55. Побединский Н.М., Орлова В.Г., Алиева Ф.К. Диагностика и лечение бесплодия, обусловленного андрогенной гиперфункцией яичников и коры надпочечников. //Акуш. и гин. -1980. -№10. С.55-57.
56. Прилепская В.Н. Вторичная аменорея у женщин репродуктивного возраста. //Дисс...докт. мед. наук. -М., 1989г. -350С.
57. Путинцева О.Г. Диагностика и лечение рецидива синдрома склерокистозных яичников. //Дисс...канд. мед. наук. -Благовещенск, 1981. -165С.
58. Пшеничникова Т.Я. Бесплодие в браке. //-М., 1991. -318С.
59. Савельева Г.М., Богинская Л.Н. Значение лапароскопии в диагностике склерокистозных яичников. //Акуш. и гин. -1982. -№10. С.17-18.
60. Серов В.Н., Кожин А.А., Сабуров Х.С. Нейро-эндокринные нарушения менструального цикла. //-Ташкент, 1984. -123С.
61. Серов В.Н., Тумилович Л.Г. Структура заболеваемости в гинекологической эндокринологии. //Акуш. и гин. -1979. -№10. -С.15-18.
62. Серов В.Н., Черепанов В.Н., Сидоров С.Н., Абдель-Махди. Склерокистозные яичники и предрак эндометрия. //Акуш. и гин. -1982. -№2. -С.24-27.
63. Серов В.Н., Прилепская В.Н., Пшеничникова Т.Я., Жаров Е.В., Кожин А.А., Кириллова Е.А. Гинекологическая эндокринология. //-М., 1995.
64. Симпсон Д.П., Глобус М.С., Мартин Э.О., Сарто Г.Е. Генетика в акушерстве и гинекологии. //-М., 1985. -352С.
65. Сметник В.П., Тумилович Л.Г. Неоперативная гинекология. //-Санкт-Петербург, 1995. С.138-346.
66. Сотникова Е.И., Дуринян Э.Р., Назаренко Т.А. и др. Синдром поликистозных яичников: вопросы патогенеза. //Акуш. и гин. - 1998. -№1. -С. 36-40.
67. Сперанская Н.В., Фанченко Н.Д. Современные представления о нейро-эндокринном контроле менструального цикла. //Акуш. и гин. -1987. -№5. -С.12-17.
68. Старкова Н.Т. Клиническая эндокринология. //-М., 1991. -512С.
69. Старкова Н.Т. Фармакотерапия в эндокринологии.// -М., 1989. -288С.
70. Тумилович Л.Г. Нейроэндокринная регуляция функции репродуктивной системы. //Акуш. и гин. -1987. -№3. -С.3-6.
71. Тумилович Л.Г., Рудченко Т.И., Малинов О.А., Анашкина Г.А. Синтез половых стероидов в поликистозных яичниках. //Тезисы докладов 6 съезда акушеров-гинекологов РСФСР. -М., 1987. -С.329.
72. Тучкина И.А. Клинико-гормональная характеристика и лечение первичного склерокистоза яичников у девочек-подростков. //Автореф. дисс...канд. мед. наук. -Харьков, 1986. -20С.
73. Фанченко Н.Д. Возрастная эндокринология репродуктивной системы женщины. //Дисс...докт. биол. наук. -М., 1988.
74. Фанченко Н.Д. Лабораторная диагностика нарушений центральной регуляции репродуктивной системы. //Пробл. репрод. -1995. -№1. -С.100-103.
75. Фанченко Н.Д., Анашкина Г.А., Торганова И.Г. О гормональной регуляции менструального цикла. //Акуш. и гин. -1986. -№5. -С.7-11.
76. Фержуа А.Б.Ю. Оценка различных методов лечения синдрома склерокистозных яичников. //Материалы Всесоюзной школы-семинара молодых ученых. -Кишинев, 1990. С.27-29.
77. Хейфец С.Н. О некоторых дискуссионных аспектах проблемы синдрома склерокистозных яичников. //Акуш. и гин. -1982. -№2. С.16-19.
78. Хейфец С.Н., Иванов Е.Г. Диагностика гиперандрогенных состояний у женщин. //Акуш. и гин. -1995. -№1. -С.12-14.
79. Цариковская Н.Г., Бирюкова М.С., Любимова Л.П., Зайцева Л.И. Консервативное лечение больных с начальной стадией склерокистозных яичников. //Акуш. и гин. -1985. -№2. С.13-16.
80. Чаба И.Ш. Клинико-морфологические и гистохимические особенности склерокистозных яичников. //Дисс...канд. мед. наук. -М., 1965. -160С.
81. Чарквиани Н.И. Функциональное состояние системы гипоталамус-гипофиз-яичник при синдроме Штейна-Левенталя. //Автореф. дисс...канд. мед. наук. -Тбилиси, 1983. -27С.
82. Юлес М., Холло И. Диагностика и патофизиологические основы нейро-эндокринных заболеваний. //-Будапешт, 1963. -416С.
83. Яремчук Т.П. Влияние клиновидной резекции яичников на состояние нейро-эндокринной системы у больных с синдромом склерокистозных яичников. //Автореф. дисс...канд. мед. наук. -Киев, 1985.
84. Adams J., Polson D.W., Franks S. Prevalence of polycystic ovaries in women with anovulation and idiopathic hirsutism //Brit. Med. J. -1986. -Vol.292, №3. -P.355-359.
85. Adams J.M., Tan S.L. et al. Uterine growth in the follicular phase of spontaneous ovulatory cycles and during luteinizing hormone-releasing hormone - induced cycles in women with normal or polycystic ovaries //Fertil. Steril. -1988. -№6. -P.49-52.
86. Adashi E.Y., Resnick C.E., D'Ercole A.J., Svoboda V.E. Insulin-like growth factor as intraovarian regulator of granulosa cell growth and function //Endocr. Rev. -1985. -№6. -P.400-420.
87. Ahlgren R., Simpson E.R., Waterman M.R., Lund J. Characterization of the promoter/regulatory region of the bovine CXP11A (P450SCC) gene: basal and cAMP-dependent expression. //J. Biol. Chem. -1990. -Vol.265, №3. -P.3313-3319.
88. Ahitila L., Koskinen P., Kaihola H. et al. Serum androgen and gonadotropin levels decline after progestogen-induced with drawal bleeding in oligomenorrheic women with or without polycystic ovaries. //Fertil. Steril. -1992. -Vol.58, №4. -P.697-702.
89. Armar N., Garrigle M.C., Honour J. et al. Laparoscopic ovarian deathermy in management of anovulatory infertility in women with polycystic ovaries: endocrine changes and clinical outcome. //Fertil. Steril. -1990. -Vol.53, №1. -P.45-49.
90. Armar N., Lachelin G. Laparoscopic ovarian diathermy: an effective treatment for antioestrogen resistant anovulatory infertility in women with the polycystic ovary syndrome. //Brit. J. Obst. Gyn. -1993. -Vol.100, №2. -P.161-164.
91. Barbieri R.L. Polycystic ovarian disease. //Annu Rev. Med. -1991. -Vol.42. -P.199-204.
92. Barnea F. Hypothalamic Amenorrhea Syndrome. //The Hypothalamus in health and disease. /Ed. J.Givens - Chicago. -1990. -116P.
93. Bercow R. et al. The Merk manual of diagnosis and therapy. Fifteenth edition, Merk and Co., Inc. Rahway, N.Y. -1987. -P.1694-1700.
94. Biderg D. et al. Aromatase activity of human granulosa cells in patients with polycystic ovaries treated with dexamethasone. //Fertil. Steril. -1990. -Vol.54, №4. -P.597-600.
95. Bogovich K. Induction of ovarian cysts in progesteron-synchronized immature rats: evidence that suppression of follicular aromatase activity is not a prerequisite for the induction of cystic follicules. //Endocrinology -1989. -Vol.124, №12. -P.1646-1653.
96. Bonney R.C., Watson H., Beesley J.S. et al. Endometrial phospholipase A2, polycystic ovaries and pelvic pain. //Brit. J. Obst. Gyn. -1992. -Vol.99, №6. -P.486-491.
97. Buvat J., Buvat-Herbaut M. Regulation de la fonction hypothalamo-hypophyso-ovarienne au cours du cycle menstrual de la femme normale /Schema d'ensemble et controle de la secretion liberation des gonadotropines par le LH-RH et les oestrogenes. //J. Gynec. Obst. Et Biol. Reprod. -1981. -Vol.10, №5. -P.415-423.
98. Buvat J., Buvat-Herbaut M., Mercolin G. et al. Purified follicule stimulatory hormone in polycystic ovary syndrome; slow administration is safer and more effective. //Fertil. Steril. -1989. -Vol.52, №1. -P.553.
99. Carmina E., Ditroff E., Malizia G. et al. Increased circulating levels of immunoreactive b-endorfin in polycystic ovary syndrome is not caused by increased pituitary secretion. //Am. J. Obst. Gyn. -1992. -№12. -P.1819-1824.
100. Cohen P.N., Givens J.R., Wiser W.L., Wilroy R.S., Summitt R.L., Coleman S.A., Andersen R.N. Polycystic ovarian disease, maturation arrest of spermatogenesis and Klinefelter's syndrome in siblings of a family with familial hirsutism. //Fertil. Steril. -1975. -Vol.26, №4. -P.1228-1238.
101. Coney P.J. Polycystic ovarian disease: current concepts of pathophysiology and therapy. //Fertil. Steril. -1984. -Vol.42, №4. -P.667-682.
102. Conway G.S., Honour J.W., Jacobs H.S. Heterogenity of the polycystic ovary syndrome: clinical, endocrine and ultrasound features in 556 patients. //Clin. Endocrinol. -1989. -Vol.30, №4. -P.459-470.
103. Cooper H.E., Spellacy W.N., Prem K.A., Cohen W.D. Hereditary factors in Stein-Levental syndrome. //Am. J. Obstet. Gynecol. -1968. -Vol.100, №7. -P.371-387.
104. Couzinet B., Thomasj G., Thalabard C. et al. Effect of a pure antiandrogen on gonadotropin secretion in normal women and in polycystic ovarian disease. //Fertil. Steril. -1989. -Vol.52, №1. -P.42-50.
105. Dale P., Tanbo T., Vaaler S., Abyholm T. Body weight, hyperinsulinemia and gonadotropin levels in the polycystic ovarian syndrome: evidence of two distinct populations. //Fertil. Steril. -1991. -Vol.58, №3. -P.487-491.
106. Daniell J.F., Miller W. Polycystic ovaries treated by laparoscopic laser vaporization. //Fertil. Steril. -1989. -Vol.51, №2. -P.232-236.
107. Dunaif A., Givens J., Haseltine F., Merriam G. Polycystic ovary syndrome (book-Oxford-London-Edinburgh). -1992. -P.1-384.
108. Eden J.A., Place J., Carter G.D. et al. Elevated free androgen index as an indicator of polycystic ovaries in oligomenorrhoea without obesity or hirsuties. //Ann. Clin. Biochem. -1988. -Vol.25, №4. -P.346-349.
109. Eden J.A., Plase J., Carter G.D. et al. The diagnosis of polycystic ovaries in subfertile women. //Brit. J. Obst. Gyn. -1989. -Vol.96, №7. -P.809-815.
110. El Kind-Hirsche K.E., Valdest T., McConnell G. Androgen responses to acutely increased endogenous insulin levels in hyperandrogenic and normal cycling women. //Fertil. Steril. -1991. -Vol.55, №3. -P.486-491.
111. El Tabbakh G.H., Azab I., Lotfy I. Et al. Correlation of the ultrasonic appearance of the ovaries in polycystic ovarian disease and the clinical, hormonal and laparoscopic findings. //Amer. J. Obstet. Gynecol. -1986. -Vol.154, №4. -P.892-895.
112. Endocrinology /Ed. J. De Groot. London; Toronto; Montreal; Sydney; Tokyo; W.W. Saunders Company, -1989. -Vol.1-3.
113. Erickson G.F., Hsueh A.G.W., Wuigley M.E. et al. Functional studies of Aromatase activity in human granulosa cells. //Steroid. -1978. -Vol.32. -P.639-648.
114. Falcone T., Billiar R., Morris D. Serum inhibin levels in polycystic ovary syndrome: effect of insulin resistence and insulin secretion. //Obst. Gyn. -1991. -Vol.78, №2. -P.171-176.
115. Francs S., Adam J., Mason H., Poison D. Ovulatory disorders in women with polycystic ovary syndrome. //Clin. Obst. Gynaec. -1985. -Vol.12, №3. -P.605-632.
116. Fritz M.A., Speroff L. Current concepts of the endocrine characteristics of normal menstrual function: the key to diagnosis and management of menstrual disorders. //Clin. Obst. Gynaecol. -1983. -Vol.26, №3. -P.647-689.
117. Futterweit W. Polycystic ovarian disease. //In: Buchsbaum H.J., ed. Clinical Perspectives in Obstetrics and Gynaecology. -New York. -1984. -156P.
118. Cadir A., Alnaser H., Mowafi R., Shaw R. The response of patients with polycystic ovarian disease to human menopausal gonadotropin therapy after ovarian electrocautery or a luteinizing hormone-releasing hormone agonis. //Fertil. Steril. -1992. -Vol.57, №2. -P.309-313.
119. Cadir A., Khatim M., Mowati R. et al. Polycystic ovaries: do these represent a specific endocrinopathy. //Brit. J. Obst. Gyn. -1991. -Vol.98, №3. -P.300-305.
120. Gindoff P.R., Jewelewicz R. Polycystic ovarian disease. // Obstet. Gynecol. Clin. N. Amer. -1987. -Vol.14, №4. -P.931-953.
121. Givens J.R. Familial polycystic ovarian disease. //Endocrinol. Metab. Clin. North Am. -1988. -Vol.17, №1. -P.1-17.
122. Golgzieher J.R., Axelrud L.R. Clinical and biochemical features of polycystic ovarian disease. //Fertil. Steril. -1963. -Vol.14, №3. -P.631-653.
123. Graf. M., Freundle G. Klinische und endokrinologische aspekte der therapie mit reinem FSH. //Zbl. Gynak. -1990. -Vol.111, №2. -P.81-90.
124. Hughesdon P.E. Morphology and morphogenesis of the Stein-Levental ovary and of so-called hyperthecosis. //Obst. Gyn. Sur. -1982. -Vol.37, №2. -P.59-76.
125. Lauber M., Ahlgren R., Walerman M.R., Simpson E.R. Characterization of the 5'-regulatory region of cytochrome P450SCC expressed in bovine luteal cells in primary culture. //72nd Annual Meeting of the Endocrine Society, Atlanta. -1990. -P.291.
126. Lenton E.A., Sexton L., Lee S., Cooke J.D. Progressive changes in LH and FSH: FSH ratio in women throughout reproductive live. //Maturitas. -1988. -Vol.10, №1. -P.35-43.
127. Louvet J.-P., Harman S., Schreiber J., Ross G. Evidence for a role of androgens in follicular maturation. //-1975. -Vol. 97, №6. -P.366-372.
128. McAllister J.M., Mason J.I., Byrd. W., Trant J.M. et al. Proliferating human granulosa-lutein cells in long-term monolayer culture: expression of aromatase, cholesterol side-chain cleavage and 3-beta-hydroxysteroid-dehydrogenage. //F. Clin. Endocrinol. Metab.
129. McKenna T.J. Pathogenesis and treatment of polycystic ovary syndrome. //N. Engl. J. Med. -1988. -Vol.318. -P.558.
130. Monosini F.P., Sarzani R., Arnadi G., Taccaliti A. Hypothalamic amenorrhea. Different patterns in the pulsatile secretion of LH during 24 hours and different responses to the stimulation test with GnRH. //Minerva Endocrinol. -1989. -Vol.14, №3. -P.153-158.
131. Nestler J., Clore N., Strauss F. et al. The effects of hyperinsulinemia on serum testosterone, progesterone, dehydroepiandrosterone sulfate and cortisol levels in normal women and in a women with hyperandrogenism, insulinresistance and acantosis nigricans. //J. Clin. Endocrin. Metab. -1987. -Vol.64, №1. -P.180-184.
132. Nobels F., Dewailly D. Puberty and polycystic ovarian syndrome: the insulin/insulin-like growth factor hypothesis. //Fertil. Steril. -1992. -Vol.58, №4. -P.655-666.
133. Oei M., Kazer R. Variability of serum gonadotropin and dehydroepiandrosterone sulfate concentrations in women with polycystic ovary syndrome. //Jour. Repr. Med. -1992. -Vol.37, №12. -P.974-979.
134. Oreasy G.W., Jaffe M.E. Pulsatile delivery systems. //Ann. N.Y. Acad. Sci. -1991. -№618. -P.548-557.
135. Ostrenski A. Endoscopic carbon dioxide laser ovarian wedge resection in resistant polycystic ovarian disease. //Int. L, Fertil. -1992. -Vol.37, №5. -P.295-299.
136. Owen E., Holownia P., Conway G. et al. 11-Beta-hydroxyandrostendione in plasma, follicular fluid and granulosa cells of women with normal and polycystic ovaries. //Fertil. Steril. -1992. -Vol.58, №4. -P.713-718.
137. Pache T., jong F., Hop W., Fauser B. Assotiation between ovarian changes assessed by transvaginal sonography and clinical and endocrine signs of the polycystic ovary syndrome. //Fertil. Steril. -1993. -Vol.59, №3. -P.544-549.
138. Peluso J., Steger R., Huang H., Meites J. Steroidogenesis in the ovary of aning cycling rats. //Exp. Aging Res. -1979. -Vol.5, №4. -P.319-333.
139. Puzigaia Z., Prelevii G., Stretenovic Z., Balini-Peric J. Ovarian enlargement as a possible marker of androgen activity in polycystic ovary syndrome. //Gyn. Endocr. -1991. -Vol.5, №3. -P.167-174.
140. Richards J., Bodovich K. Effects of human chorionic gonadotropin and progesterone on follicular development in the immature rat. //Endocrinology. -1982. -Vol.111, №10. -P.1429-1438.
141. Remorgida V., Venturini P.L., Anserinr P. et al. Use of combined exogenous gonadotropin and pulsatile gonadotropin-releasing hormone in patients with polycystic ovarian syndrome. //Fertil. Steril. -1991. -Vol.55, №1. -P.61-65.
142. Rimington M.R., Chui David Rc., Walker Sh. Et al. Laparoscopic ovarion electrocautery as a method of preventing ovarian hyperstimulation syndrome in women with polycystic ovarion syndrome undergoing IVF. //Congress for gynecologic endoscopy. -London, 1995. -P.42.
143. Roberts S.J. Clinical observations on cystic ovaries in dairy cattle. //Cornell Vet. J. -1955. -Vol.45, №5. -P.497-513.
144. Rodgers R.J., Waterman M.R. etc. Levels of messenger ribonucleic acid endocind cholesterol side-chain cleavage cytochrome P-450, 17-a-hidroxylase P-450, adrenodoxin and low-density lipoprotein receptor in bovine follicules and corpora lutea throughout the ovarian cycle. //Mol. Endocrinol. -1987. -Vol.1, №3. -P.274-279.
145. Rosenfield R.L., Barnes B.B., Cara J.F., Lucky A.W. Dysregulation of cytochrome P450s17-Alfa as the cause of polycystic ovarian syndrome. //Fertil. Steril. -1990. -Vol.53, №5. -P.785-791.
146. Rossmanith W.G. Circadian and ultradian rythms in gonadotropin secretion: regulation by ovarian steroids. //Geburtshilfe - Frauenheilkd. -1991. -Vol.51, №8. -P.585-594.
147. Santoro N., Crowley W. Disorders of endogenous GnRH secretions; hypogonadotropic hypogonadism, polycystic ovarian disease, inadequate luteal phase. Pulsatil GnRH 1986. //Poc. Of the 3-rd Ferring Symposium Nordwijk 11-13/9 1985. -P.51-62.
148. Shoham Z., Conway G., Patel A., Jacobs H. Polycystic ovaries in patients with hypogonadotropic hypogonadism: simularity of ovarian response to gonadotropin stimulation in patients with polycystic ovarian syndrome. //Fertil. Steril. -1992. -Vol.58, №1. -P.37-45.
149. Simpson J.L., Rebar R.W. Normal and abnormal sexual differentiation and development. //Philadelphia: JB Lippincott Co. -1990. -P.710-739.
150. Simpson J.L. Disorders of gonads and internal reproductive ducts. //In: Emery AEH, Rimoin L.L., eds Principles and Practics of Medical Genetics, 2nd end. -Edinburgh: Churchill Livingstone. -1990. -P.1593-1616.
151. Simpson J.L. The de Watterwille Memorial Lecture: Reproductive technologies and genetic advances in obstetrics and gynecology. //Int. J. Gynecol. Obstet. -1992. -Vol.38, №2. -P.261-280.
152. Stein B.S. Genital system. //In: Catcott E.J., ed. Feline Medicine and Surgery. -Santa-Barbara: American Veterinary Publications. -1975.
153. Stein J., Levental J.M. Amenorrhea assotiated with bilateral polycystic ovaries. //Amer. J. Obst. Gynec. -1935. -Vol.29. -P.181-191.
154. Yen S.S.C. Polycystic ovarian syndrome. //Clin. Endocrinol. -1980. -Vol.12. -P.177-208.
155. Zuber M.X., Simpson E.R., Waterman M.R. Expression of bovine 14-alfa-hydroxylase cytochrome P450 cDNA in nonsteroidogenic cells. //Science -1986. -№6. -P.1258-1261.
