Дифференциальная диагностика критической и субкритической степеней ишемии путем изучения параметров микроциркуляции методом лазерной допплерфлоуметрии (ЛДФ) на фоне нереконструируемого хронического окклюзионного заболевания артерий нижних конечностей (Хозанк).
Кротовский Г.С., Зудин А.М., Учкин И.Г.
Отдел хирургии сосудов, ММА им. И.М. Сеченова, г. Москва, Россия.
Руководитель - д.м.н., профессор Г.С. Кротовский
Проблема диагностики и лечения больных с критической ишемией нижних конечностей на фоне не реконструируемого поражения их артериального русла остается актуальным и не до конца решенным вопросом современной ангиологии и сосудистой хирургии. В представленной статье опубликован опыт применения метода ЛДФ для диагностики состояния и ресурсов микроциркуляторной системы конечности на фоне хронической критической ишемии. В результате исследования установлено, что имеют место существенные различия параметров микроциркуляторной гемодинамики по данным ЛДФ у больных с хронической критической и субкритической ишемией нижних конечностей. По нашему мнению эти отличия могут быть использованы в дифференциальной диагностике
Ключевые слова: хроническая критическая ишемия; ЛДФ.
Введение. Целью настоящего исследования является изучение параметров гемодинамики микроциркуляторного русла методом ЛДФ у больных с хронической критической и субкритической ишемией нижних конечностей на фоне ХОЗАНК. Практическая значимость исследования микроциркуляторной гемодинамики заключается в определении ресурсов микроциркуляторного русла и тем самым выбора способа лечения у больных с нереконструируемым окклюзионным поражением артерий нижних конечностей. Дифференциальная диагностика между субкритической и критической степенями ишемии по мнению многих авторов [1, 2, 7] является важной задачей, от решения которой в большой мере зависит прогноз лечения больных с нереконструируемым поражением артериальной системы.
В настоящее время разработано и применяется большое количество паллиативных методов лечения таких больных. В Отделе хирургии сосудов ММА им. И.М. Сеченова в качестве способов лечения у больных с нереконструируемым поражением артериального русла нижних конечностей применяются методы реваскуляризирующей остеотрепанации (РОТ) по методике Ф.Н. Зусмановича [4], поясничной симпатэктомии (ПСЭ), терапия препаратами группы простагландинов Е1 (ПГЕ1), а также различные варианты сочетания этих методик.
Материал и методы исследования. В ходе нашего исследования было обследовано и оперировано 86 пациентов. Все они были разделены на четыре равноценные по тяжести состояния группы: I группа - больные перенесшие РОТ изолированно; II группа - больные перенесшие РОТ в сочетании с поясничной симпатэктомией (ПСЭ); III группа - больные перенесшие операцию РОТ в сочетании с курсом инфузионной терапии препаратами группы простагландинов Е1 (ПГЕ1) - использовался «Вазапростан» и IV группа - больные, которые перенесли РОТ на пораженной конечности в сочетании с поясничной симпатэктомией на этой же стороне и курс инфузионной терапии препаратами группы простагландинов Е1. Больные первой группы составили группу «сравнения». Возрастная характеристика пациентов представлена в таблице №1. Сроки наблюдения за оперированными больными составили от 1 месяца госпитального периода до 3 лет.
Основным клиническим проявлением, которое имело место у больных, отобранных для исследования, было наличие постоянной «боли покоя» в дистальных отделах конечностей на фоне ХОЗАНК. При этом диагноз «хроническая критическая (или субкритическая) ишемия нижних конечностей» устанавливался, согласно Документу Европейского соглашения по критической ишемии нижних конечностей, при наличии клинических признаков этих степеней ишемии в течение не менее 2-х недель [2, 3].
Причинами хронического окклюзионного поражения артериального русла нижних конечностей у обследованных больных являлись облитерирующий атеросклероз и облитерирующий эндартериит. Соотношение этих двух нозологических форм в исследуемой группе больных оказалось практически таким же, как и в целом в структуре заболеваемости ХОЗАНК. На первом месте шел облитерирующий атеросклероз - 78 пациентов (90,7%), на втором - облитерирующий эндартериит 8 (9,3%).
Как известно, наличие постоянных болей в конечности находящейся в состоянии покоя на фоне ХОЗАНК, является основным критерием третьей стадии хронической ишемии нижних конечностей по классификации Фонтейна. Однако в нашем исследовании применена дополненная классификация Фонтейна, которая была впервые предложена в Документе Европейского соглашения по критической ишемии нижних конечностей (1989 год, Берлин) [3]. Согласно данной классификации выделяются стадии субкритической (IIIA) и критической (IIIБ) ишемии. По данным Савельева В.С. и соавт. разница между стадиями IIIA и IIIБ заключается в ряде клинических и патофизиологических отличий. Главными клиническими различиями между субкритической и критической ишемией являются, во-первых, наличие «ишемического отека голени», а во-вторых - вынужденное опускание пораженной конечности с кровати с частотой не менее одного раза в 2-2.5 часа. При оценке ишемического отека использовалось измерение окружности голени в нижней трети пораженной и контралатеральной конечностей. Наличие разницы в окружности более 2 см на фоне признаков ХОЗАНК расценивалось как наличие ишемического отека [9, 10].
Различия между стадиями ишемии IIIA и IIIБ касаются не только клинических признаков, но и целого ряда физиологических характеристик. Помимо различий в таких физиологических параметрах как в ходе настоящего исследования была установлена разница в состоянии резервов системы микроциркуляции при ишемии IIIA и IIIБ путем обследования микроциркуляторного русла пораженной конечности методом ЛДФ.
Среди обследованных нами пациентов ишемия IIIБ (критическая) наблюдалась у 42-х из 86-ти больных. В первой группе критическая ишемия имела место у 11 больных из 25 (44.0%), во второй группе - у 8 больных из 22 (36.4%), в третьей группе - у 12 больных из 21 (57.1%) и в четвертой группе - у 11 больных из 18 (61.1%)
В качестве основного метода, характеризующего функциональные ресурсы микроциркуляторного русла ишемизированной конечности, нами была применена ЛДФ, которая использована с целью изучения капиллярной перфузии кожи и определения микроциркуляции мышечной ткани, а также объективизации резервов системы микроциркуляции в дооперационном периоде [6, 8]. В послеоперационном периоде также оценивались показатели тканевой микроциркуляторной перфузии с целью уточнения результатов операции в сочетании с другими способами лечения или без них. Исследования проводились с помощью аппарата BLF-21 фирмы Transonic Systems Inc., США.
При исследовании кожной микроциркуляции использовались датчики измерения поверхностных кровотоков типа R (right angle) диаметром 15 мм. Исследование производится в изолированном помещении после 20 минутной адаптации больного при температуре воздуха 20°С в положении лежа. Перед исследованием пациентам необходимо исключить прием вазоактивных препаратов в течение 3-6 часов и курение в течение 1,5 - 2 часов.
Датчики фиксировались липким кольцом к поверхности кожи, которая была предварительно обрита и обезжирена, в двух стандартных областях: на подошвенной поверхности ногтевой фаланги I пальца стопы; на тыле стопы в первом межпальцевом промежутке. Данные области выбраны в связи с принципиальной разностью гистологического строения микроциркуляторного сосудистого слоя. Кожа ногтевой фаланги пальца стопы является зоной с чрезвычайно богато представленной сетью артериовенозных анастомозов, в то время как на тыльной поверхности стопы таковые практически отсутствуют [5].
Для изучения мышечного кровотока использовался датчик типа N (18 gauge needle). В асептических условиях на уровне границы средней и нижней трети голени в медиальную головку икроножной мышцы пункционно устанавливалась одноразовая игла, по внутреннему просвету которой проводился датчик.
Фиксировался исходный (базальный) кровоток в течение трех минут, что позволило после усреднения данных избежать влияния дыхательных колебаний тканевой перфузии на конечный результат.
Для оценки тканевой микроциркуляции проводился ряд функциональных тестов, так как наибольший интерес для нас представляла не исходная перфузия, а способность микроциркуляторного русла реагировать на те или иные воздействия:
1) Тест реактивной постокклюзионной гиперемии;
2) Проба Вальсальвы;
3) Позиционная проба;
4) Проба с препаратами ПГЕ1 (использовался «Вазапростан»).
Тест реактивной постокклюзионной гиперемии заключался в регистрации кожного кровотока после 3-х минут окклюзии сосудов. Пациенту накладывалась манжета на нижнюю треть бедра и нагнеталось давление 250-300 мм рт. ст. После нагнетания давления записывался «биологический ноль», представляющий собой часть случайного допплеровского сигнала, который регистрируется даже при полной артериальной окклюзии. Затем снимается окклюзия и фиксируется перфузия во время реактивной гиперемии. При этом оценивается величина прироста кровотока по сравнению с исходным, время, через которое возникал прирост кровотока, а также время, в течение которого реактивная гиперемия исчезала.
При пробе Вальсальвы оценивалась реакция микроциркуляторного русла на симпатические воздействия. Исследование проводилось при задержке дыхания в течение 15 сек. на высоте максимального вдоха. При этом снижение кровотока на 30±5% в ответ на симпатическую стимуляцию оценивалось как норма.
При позиционной пробе определялась микроциркуляция при опускании конечности ниже уровня сердца. Оценивалась степень снижения микроциркуляции в ответ на увеличение капиллярного давления при опускании конечности.
При пробе с «Вазапростаном» повторяли предыдущие три функциональные пробы на фоне внутривенного капельного введения 80 мкг препарата. При этом проводилось сравнение показателей проб и тем самым определялась чувствительность микроциркуляторной системы на вазодилатирующее воздействие препаратов ПГЕ1.
Результаты.
Подавляющее большинство исследователей, занимающихся изучением микроциркуляции конечности на фоне ишемии, отмечают, что абсолютные показатели тканевого кровотока имеют тенденцию к снижению с прогрессированием облитерирующего процесса. Однако статистически достоверные различия (p<0.05) получены только для стадий с выраженной тканевой ишемией. При этом разница между стадиями критической и субкритической ишемии в абсолютных цифрах тканевой перфузии невелика (см. Диаграмму № 1 и Таблицу № 1).
Диаграмма № 1
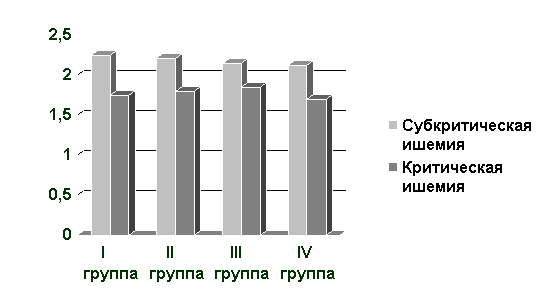
Цифры абсолютной тканевой перфузии по данным ЛДФ на I пальце стопы у больных
всех групп.
Для определения функциональных резервов системы микрососудов ишемизированной конечности мы, как уже говорилось ранее, использовали тест реактивной постокклюзионной гиперемии, пробу Вальсальвы, позиционную пробу и пробу с препаратами группы ПГЕ1.
Для интерпретации данных теста постокклюзионной гиперемии нами был использован ряд количественных характеристик, которые, по мнению ряда авторов, считаются наиболее чувствительными при выполнении постишемической пробы [Мач Э.С., Hoffman U., Seifert H., Beinder E., Bollinger A.]:
а) время до максимального постокклюзионного кровотока (Тмпок);
б) максимальный постокклюзионный кровоток (МПОК);
в) постокклюзионный прирост кровотока, выраженный в процентах (ПОПК).
Подсчет ПОПК выполнялся по формуле: ПОПК=(МПОК/Базовый кровоток)х100%.
Таблица № 1
Абсолютные цифры тканевой перфузии в различных участках конечности у больных с критической и субкритической ишемией по группам (р<0.05)
| Исследуемые области | I ГРУППА | II ГРУППА | III ГРУППА | IV ГРУППА | ||||
|
Ишемия
IIIА |
Ишемия IIIБ | Ишемия IIIА | Ишемия IIIБ |
Ишемия
IIIА |
Ишемия IIIБ | Ишемия IIIА | Ишемия IIIБ | |
| па лец стопы, TPU | 2.25±0.05 | 1.75±0.05 | 2.21±0.03 | 1.80±0.01 | 2.15±0.05 | 1.85±0.03 | 2.12±0.03 | 1.70±0.01 |
| Тыл стопы, TPU | 1.12±0.02 | 0.09±0.01 | 1.21±0.01 | 0.08±0.02 | 1.18±0.03 | 0.10±0.02 | 1.30±0.04 | 0.09±0.02 |
| Икроножная мышца, TPU | 3.29±0.01 | 2.33±0.03 | 3.28±0.02 | 2.32±0.01 | 3.29±0.01 | 2.33±0.02 | 3.29±0.01 | 2.34±0.02 |
| Количество больных: | 14 | 11 | 14 | 8 | 12 | 9 | 7 | 11 |
| Всего больных в группе: | 25 | 22 | 21 | 18 | ||||
При анализе данных, полученных в результате теста постокклюзионной гиперемии установлено, что между критической и субкритической стадиями ишемии конечности отмечается ряд существенных различий по степени реактивности микроциркуляторного русла (см. Таблицу № 2).
Как видно из приведенных в таблице цифр, разница между субкритической и критической степенями ишемии определяется по всем параметрам постокклюзионного кровотока (наиболее информативной оказалась регистрация изменений на подошвенной поверхности I пальца стопы).
Аналогичные по своей сути данные обнаружены при исследовании тканевой перфузии на фоне пробы Вальсальвы, позиционной пробы и пробы с препаратами группы ПГЕ1.
При пробе Вальсальвы реакция микроциркуляторного русла на симпатическое раздражение при ишемии IIIA более выражена, чем при ишемии IIIБ (См. таблицу № 3). Реактивность системы микроциркуляции оценивалась в процентном отношении от уровня исходной перфузии ткани.
При оценке изменения кровотока на фоне пробы Вальсальвы отмечена достоверная разница интенсивности тканевой перфузии между критической и субкритической степенями ишемии во всех четырех исследуемых группах. В среднем остаточный кровоток тканей на фоне субкритической ишемии при проведении пробы Вальсальвы на 10% ниже, чем на фоне критической ишемии, что свидетельствует о более высоких функциональных резервах системы микроциркуляции при ишемии IIIA. Более высокая реактивность тканевой перфузии на симпатическое воздействие во второй и четвертой группах объясняется тем, что именно наличие выраженной реакции расценивалось нами как одно из оснований для выполнения пациенту ПСЭ. Исследование тканевой перфузии на фоне позиционной пробы также обнаружило ряд различий между субкритической и критической степенями ишемии (См. таблицу № 4).
